- سوالات استخدامی نقاشی ایرانی از دیروز تا امروز (دبیر فرهنگ و هنر)
- سوالات استخدامی هنر و تمدن اسلامی (دبیر فرهنگ و هنر)
- سوالات استخدامی دبیری فرهنگ و هنر با پاسخنامه (حیطه تخصصی)
- تولید صابون از پلاستیک های دور ریز
- پنج توصیه ویژه برای والدینی که فرزندشان کنکوری است
- مهروماه در سی و پنجمین نمایشگاه کتاب تهران
- سوالات ضمن خدمت محور مهارت های فردی و اجتماعی ( زندگی با قرآن و عترت و آشنایی با حکمت های نهج البلاغه ) سال ۱۴۰۳
- پاورپوینت گل های آپارتمانی
- پاورپوینت گل های آپارتمانی زینتی
- سوالات استخدامی راهنمای معلم فرهنگ و هنر (دبیر فرهنگ و هنر)
آخرین مطالب
امکانات وب
از جمله راههای گزارش گرمای جذب شده یا آزاد شده در واکنش شیمیایی، بهرهگیری از جداول بسیار زیادی از تغییرات آنتالپی برای تمامی واکنشهای شیمیایی است که به طور قطع، این کار بسیار دشوار خواهد بود. خوشبختانه قانون هس به ما کمک میکند تا به کمک برخی از جداول، تغییرات آنتالپی را برای بیشتر واکنشها حساب کنیم. آنچه که در این آموزش قصد داریم به آن بپردازیم، بیان آنتالپی استاندارد تشکیل یا گرمای استاندارد تشکیل است. آنتالپی استاندارد تشکیل یک ترکیب به تغییرات آنتالپی به هنگام تشکیل یک مول ماده از عناصر تشکیل دهنده آن میگویند که تمامی مواد در حالت استاندارد خود باشند.
آنتالپی تشکیل
آنتالپی تشکیل $$(ΔH_f)$$، به تغییر آنتالپی برای تشکیل ۱ مول ترکیب از اجزای سازنده آن میگویند. به عنوان مثال میتوان به تشکیل دیاکسید کربن از اتمهای کربن و اکسیژن اشاره کرد. رابطه متناظر با آنتالپی تشکیل را میتوان به شکل زیر نشان داد:
ترکیب $$rightarrow$$ عناصر
$$Delta H_{rxn} = Delta H_{f}$$
به طور مثال، واکنش سوختن کربن را در نظر بگیرید:
$${ C(s) + O2 (g) rightarrow CO2 (g)} $$
$$Delta H_{rxn} = Delta H_{f}left [CO_{2}left ( g right ) right ]$$
علامت آنتالپی تشکیل، همانند سایر علامتهای تغییر آنتالپی است. زمانی که برای تشکیل یک ترکیب، گرما آزاد شود، علامت آنتالپی تشکیل، منفی و اگر گرما جذب شود، علامت آنتالپی، مثبت خواهد بود.
آنتالپی استاندارد تشکیل چیست؟
مقدار $$Delta H $$ برای یک واکنش به حالت فیزیکی واکنشدهندهها و فرآوردهها، فشار هر نوع گاز موجود و دمای واکنش وابسته است. برای اینکه شرایط مختلف واکنش، مشکلاتی را بوجود نیاورند و همچنین به منظور داشتن دادههایی یکپارچه، شرایط ویژهای مشخص شده است که تحت آن، تغییرات آنتالپی اندازهگیری شوند. این شرایط استاندارد به عنوان نقطهای مرجع در اندازهگیری اختلاف آنتالپی شناخته میشوند. همانطور که از سطح دریاهای آزاد به عنوان نقطه مرجع برای بیان ارتفاع قلهها استفاده میکنیم، نقطه مرجعی نیز برای بیان آنتالپی باید داشته باشیم.
شرایط استانداردی که بیشتر دادههای ترمودینامیکی در آن فهرست میشوند، فشار ۱ اتمسفر برای تمامی گازها و غلظت ۱ مولار برای تمامی ذرات موجود در یک محلول است. علاوه بر این، هر ماده خالصی نیز باید در شرایط استاندارد خود قرار داشته باشد که در بیشتر موارد، پایدارترین حالت آن و در فشار ۱ اتمسفر در دمایی مشخص خواهد بود. این دمای مشخص، به طور معمول، ۲۵ درجه سانتیگراد ذکر میشود که ما در طول این متن نیز همین دما را در نظر خواهیم داشت. آنتالپی اندازهگیری شده تحت شرایط بالا موسوم به آنتالپی استاندارد تشکیل است که با $$ΔH^o_f$$ آنرا نمایش میدهند.
به بیان دیگر، تغییر آنتالپی برای تشکیل ۱ مول از یک ترکیب از اجزای سازنده آن، آنتالپی استاندارد تشکیل نام دارد که تمامی این اجزای سازنده باید در شرایط استاندارد خود باشند. آنتالپی استاندارد تشکیل هر عنصر در پایدارترین حالت آن، طبق تعریف، صفر در نظر گرفته میشود.
به طور مثال، با وجود اینکه اکسیژن میتواند به فرم اوزون $$(O_3)$$، اکسیژن اتمی $$(O)$$ و مولکول اکسیژن $$(O_2)$$ وجود داشته باشد، مولکول دواتمی اکسیژن در فشار ۱ اتمسفر و دمای ۲۵ درجه سانتیگراد، پایدارترین حالت آن به شمار میآید. در مورد هیدروژن نیز به جای اتم $$H$$، مولکول $$H _ 2 (g)$$ به عنوان حالت استاندارد هیدروژن شناخته میشود. گرافیت و الماس، هر دو از آلوتروپهای کربن به شمار میآیند اما از آنجایی که گرافیت در فشار ۱ اتمسفر و دمای ۲۵ درجه سانتیگراد پایداری بیشتری نسبت به الماس دارد، حالت استاندارد کربن، گرافیت خواهد بود. بنابراین $$O_2 (g)$$، $$H _ 2 (g)$$ و گرافیت دارای $$ΔH^o_f$$ برابر با صفر هستند.

آنتالپی استاندارد تشکیل گلوکوز از عناصر سازنده آن در دمای ۲۵ درجه سانتیگراد برابر با تغییرات آنتالپی واکنش زیر است:
$$6 C left (s, graphite right ) + 6 H _ {2}left (g right ) + 3 O _ {2}left (g right ) rightarrow C _ {6} H_ {12} O _ {6}left (s right ); ; ; Delta H_{f}^{o} = – 1273.3 ; kJ $$
نمیتوان تنها با ترکیب گردن گرافیت، اکسیژن و هیدروژن، مقدار آنتالپی استاندارد تشکیل گلوکوز را محاسبه کرد. واکنشی که در بالا نشان داده شده است، در هیچ شرایطی به میزان قابل سنجشی انجام نمیگیرد. البته گلوکز ترکیب ویژهای نیست؛ بسیاری از ترکیبات را نمیتوان بر اساس معادله شیمیایی تعریف شده برای آنتالپی استاندارد تشکیل، تهیه کرد. به جای آن، مقادیر را به کمک قانون حس و تغییرات آنتالپی استاندارد اندازهگیری شده سایر واکنشها همچون واکنش سوختن، بدست میآورند. مقادیر آنتالپی استاندارد تشکیل را به طور معمول در جداول مخصوصی ارائه میکنند. توجه داشته باشید که این مقادیر همواره به صورت کیلوژول بر مول بیان میشوند.
با توجه به اهمیت مبحث آنتالپی در شیمی فیزیک، «فرادرس» اقدام به انتشار فیلم آموزش شیمی فیزیک کرده که لینک آن در ادامه آورده شده است.
- برای دیدن فیلم آموزش شیمی فیزیک + اینجا کلیک کنید.
آنتالپی استاندارد واکنش
از مقادیر آنتالپی استاندارد تشکیل میتوان برای محاسبه تغییرات آنتالپی هر واکنشی استفاده کرد که مواد شرکت کننده در آن واکنش، $$ΔH^o_f$$ مشخصی داشته باشند. آنتالپی استاندارد واکنش $$(Delta{H_{rxn}^o})$$ به تغییر آنتالپی میگویند که حاصل از واکنشی با واکنشدهندهها و فرآوردهها در شرایط استاندارد باشد. واکنش کلی زیر را در نظر بگیرید:
$$a A + b B rightarrow c C + d D $$
در این معادله، A، B، C و D، مواد شیمیایی و a،b،c و d ضرایب استوکیومتری هستند. مقدار $$ΔH^ο$$ برابر با مجموع آنتالپیهای استاندارد تشکیل فرآوردهها منهای مجموع آنتالپیهای استاندارد واکنشدهندهها است که مقدار هر کدام در ضریب استوکیومتری آن ضرب شده است.
$$Delta H_{rxn}^{o} = underbrace { left [cDelta H _{f}^ {o} left ( C right ) + dDelta H _{f}^ {o} left ( D right ) right ] }_{text {products} } – underbrace { left [aDelta H _ {f}^ {o}left ( A right ) + b Delta H _{f}^{o}left ( B right ) right ]} _ {text {reactants }} $$
به طور کلی رابطه بالا را میتوان به شکل زیر نوشت:
$$Delta H_ {rxn} ^ {o} = sum m Delta H _ {f} ^ {o} left ( products right ) – sum nDelta H _ {f } ^ {o} left ( reactants right ) $$
در این رابطه، m و n به ترتیب ضرایب استوکیومتری هر فرآورده و واکنشدهنده هستند. این رابطه را به این دلیل به شکل «فرآورده منهای واکنشدهنده» مینویسند زیرا آنتالپی، یک تابع حالت است. از آنجایی که بسیاری از کمیات الکتروشیمیایی نیز تابع حالت هستند، عبارت «فرآورده منهای واکنشدهنده» در شیمی بسیار معمول است.
برای اینکه از مقادیر آنتالپی استاندارد استفاده کنیم، مقدار $$Delta H_{rxn}$$ را برای سوختن گلوکوز محاسبه میکنیم. در واقع این واکنش، انرژی مورد نیاز سلولهای مغز را تامین میکند.
$$C_{6} H_{12} O _ {6} left ( s right ) + 6 O _ {2} left ( g right ) rightarrow 6 CO _ {2}left ( g right ) + 6 H _ {2}O left ( l right ) $$
با استفاده از روابط بالا، آنرا به صورت زیر مینویسیم:
$$Delta H _ {f}^{o} =left { 6Delta H _ {f}^ {o} left [ C O _{2}left ( g right ) right ] + 6 Delta H _{f}^ {o}left [ H _{2} O left ( g right ) right ] right } – left { Delta H _ {f}^ { o} left [ C _{6}H_ {12} O _{6} left ( s right ) right ] + 6 Delta H _{f }^ {o} left [ O_ {2}left ( g right ) right ] right } $$
با استفاده از جداول ترمودینامیکی، مقادیر زیر را برای آنتالپیهای استاندارد تشکیل واکنشدهندهها و فرآوردهها یادداشت میکنیم:
$$begin{equation}
left.Delta mathrm{H}^{circ} mathrm{f}left[mathrm{CO}_{2}(mathrm{g})right]=-393.5 mathrm{kJ}right / mathrm{mol} \
Delta mathrm{H}_{mathrm{f}}left[mathrm{H}_{2} mathrm{O}(mathrm{I})right]=-285.8 mathrm{kJ} / mathrm{mol}\
Delta mathrm{H}^{circ} mathrm{f}left[mathrm{C}_{6} mathrm{H}_{12} mathrm{O}_{6}(mathrm{s})right]=-1273.3 mathrm{kJ} / mathrm{mol}
end{equation}$$

با توجه به اینکه مولکول دو اتمی اکسیژن در حالت گاز به عنوان حالت استاندارد شناخته میشود، آنتالپی استاندارد تشکیل برای آنرا صفر در نظر میگیریم. در تصویر زیر، دو مسیر برای رسیدن به فرآورده از واکنشدهنده نشان داده شده که مسیر مستقیم، با فلش سبزرنگ مشخص شده است. مسیر جایگزین دیگر، شامل چهار واکنش مجزا است که در طی آنها، ابتدا واکنشدهندهها به عناصر در حالت استاندارد خود تبدیل میشوند و در ادامه نیز این عناصر، به فرآوردههای مورد نظر تبدیل خواهند شد که با فلشهای بنفشرنگ نشان داده شدهاند.
واکنشی که واکنشدهندهها را به عناصر تبدیل میکند، عکس معادلات تعریف کننده مقادیر $$ΔH^ο_f$$ است. بنابراین، تغییرات آنتالپی را با روابط زیر بدست میآوریم:
$$begin{align} require {cancel} Delta H_{1}^{o} &= Delta H_{f}^{o} left [ glucose left ( s right ) right ] nonumber \[4pt] &= -1 ; cancel{mol ; glucose}left ( dfrac{1273.3 ; kJ}{1 ; cancel{mol ; glucose}} right ) nonumber \[4pt] &= +1273.3 ; kJ nonumber \[4pt] Delta H_{2}^{o} &= 6 Delta H_{f}^{o} left [ O_{2} left ( g right ) right ] nonumber \[4pt] & =6 ; cancel{mol ; O_{2}}left ( dfrac{0 ; kJ}{1 ; cancel{mol ; O_{2}}} right ) nonumber \[4pt] &= 0 ; kJ end{align} $$
بنابراین، تغییرات کلی آنتالپی برای تبدیل واکنشدهندهها (۱ مول گلوکوز و ۶ مول $$O_2$$) به عناصر، برابر با $$+1273.3 kJ$$
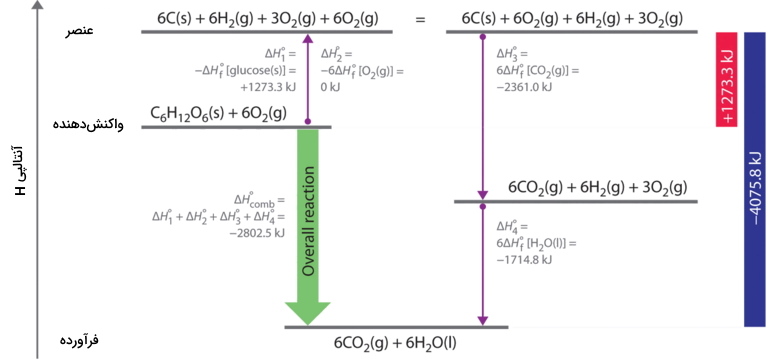
واکنشهایی که عناصر را به فرآورده نهایی تبدیل میکنند مشابه با آنچیزی هستند که برای تعریف مقادیر آنتالپی استاندارد تشکیل فرآوردهها بیان شدند. به همین دلیل، تغییرات آنتالپی را میتوان به کمک روابط زیر محاسبه کرد.
$$begin {matrix} Delta H_{3}^{o} = Delta H_ {f}^{ o} left [ C O _{2} left ( g right ) right ] = 6 ; cancel {mol ; C O _{2}}left ( dfrac {393.5 ; k J } {1 ; cancel {mol ; CO_{2}}} right ) = -2361.0 ; kJ \ Delta H_{4} ^{o} = 6 Delta H _{f}^ {o} left [ H _{2} O left ( l right ) right ] = 6 ; cancel {mol ; H _{2} O }left ( dfrac{-285.8 ; kJ} {1 ; cancel {mol ; H _{2} O}} right ) = -1714.8 ; kJ end {matrix}$$
بنابراین، تغییرات کلی آنتالپی برای تبدیل عناصر به فرآوردهها (۶ مول دیاکسید کربن و ۶ مول آب مایع) برابر با $$−4075.8 kJ$$ خواهد بود. از آنجایی که آنتالپی، یک تابع حالت محسوب میشود، تفاوت آنتالپی بین حالت اولیه و حالت نهایی را میتوان از هر مسیری حساب کرد. بنابراین، تغییر آنتالپی برای سوختن گلوکز و تبدیل آن به دیاکسید کربن و آب برابر با مجموع تغییرات آنتالپی برای تبدیل گلوکز و اکسیژن به عناصر و تبدیل عناصر به دیاکسید کربن و آب است که این رابطه آنرا در زیر مشاهده میکنید.
$$Delta H_{comb}^{o} = +1273.3 ; kJ +left ( -4075.8 ; kJ right ) = -2802.5 ; kJ label{7.8.10}$$
این همان نتیجهای است که از عبارت «فرآورده منهای واکنشدهنده» بدست میآوردیم.
مثال محاسبه گرمای سوختن
اسیدهای چرب بلندزنجیر همچون پالمیتیک اسید با فرمول $${CH_3 (CH_2)_{14} CO_2H}$$، یک از دو منبع اصلی انرژی در رژیم غذایی ما محسوب میشوند و آنتالپی استاندارد تشکیل این ماده برابر با $$−891.5 kJ/mol$$ است. با استفاده از جداول ترمودینامیکی آنتالپی استاندارد تشکیل، آنتالپی استاندارد سوختن پالمیتیک اسید را محاسبه و بیان کنید گلوکز یا پالمیتیک اسید، کدامیک سوخت بهتری هستند.
برای محاسبه انرژی آزاد شده در اثر سوختن پالمیتیک اسید، باید آنتالپی استاندارد تشکیل را محاسبه کنیم. همانند همیشه، در ابتدا باید معادله موازنه شده را بنویسیم:
$$C_ {16} H_ {32} O _ {2 ( s ) } + 23 O_ {2 (g)} rightarrow 16 C O _ {2(g)} + 16 H _ 2O _ {(l)}$$
با استفاده از عبارت «فرآورده منهای واکنشدهنده» به همراه آنتالپیهای استاندارد تشکیل، خواهیم داشت:
$$begin {align*} Delta H_ {comb}^ {o} &= sum m Delta {H ^ o} _ f left ( {products} right) – sum n Delta {H^o} _f left ( {reactants} right) \ [4pt] &= left [ 16left ( -393.5 ; kJ/mol ; C O _ {2} right ) + 16 left ( -285.8 ; kJ/mol ; H_ {2}O ; right ) right ] \[4pt] & – left [ -891.5 ; kJ/mol ; C_ {16}H _ {32} O _ { 2 } + 23 left ( 0 ; kJ/mol ; O_{2} ; right ) right ] \[4pt] &= -9977.3 ; kJ/mol nonumber end {align*}$$
عدد بدست آمده، انرژی آزاد شده حاصل از سوختن ۱ مول پالمیتیک اسید است. در ادامه، انرژی آزاد شده به هنگام سوختن ۱ گرم پالمیتیک اسید را با توجه به جرم مولی آن محاسبه میکنیم:
$$Delta H_{comb}^{o} ; per ; gram =left ( dfrac {9977.3 ; kJ }{cancel {1 ; mol}} right ) left ( dfrac{cancel {1 ; mol}}{256.42 ; g} right ) = -38.910 ; kJ/g nonumber$$
پیشتر، انرژی آزاد شده حاصل از سوختن ۱ مول گلوکز را محاسبه کردیم. انرژی آزاد شده حاصل از سوختن ۱ گرم گلوکز را نیز به شکل زیر حساب میکنیم:
$$Delta H _ {comb}^ {o} ; per ; gram = left ( dfrac {-2802.5 ; k J } {cancel{ 1; mol}} right ) left ( dfrac {cancel{1 ; mol}}{180.16; g} right ) = -15.556 ; kJ/g $$
علاوه بر موارد بالا، همچنین میتوانیم تغییرات آنتالپی برای واکنش دیگری همچون واکنش سوختن را محاسبه کنیم و سپس، از آن برای محاسبه آنتالپی استاندارد تشکیل یک ترکیبی استفاده کنیم که توانایی محاسبه آنرا به روش دیگر نداریم. این مورد را در مثال زیر مورد بررسی قرار میدهیم.
مثال محاسبه آنتالپی استاندارد تشکیل
در اوایل سال 1923، از «تترا اتیل سرب» (Tetraethyllead) با فرمول $${(C_2 H_5) _4 Pb}$$ به عنوان افزودنی ضد کوبش گازوئیل استفاده میشد. استفاده از آن در آمریکا بعد از سال ۱۹۸۶ به دلیل خاصیت سمی سرب، به طور کامل منسوخ شد. تترا اتیل سرب، مایعی بیرنگ و بسیار سمی است که با سوختن در هوا، شعلهای نارنجی با هالهای سبزرنگ تولید میکند. فرآوردههای سوختن این ماده، آب، گاز دیاکسید کربن و $${PbO(s)}$$ جامد است. اگر مقادیر زیر را داشته باشیم، آنتالپی استاندارد تشکیل واکنشدهنده (تترا اتیل سرب) را محاسبه کنید:
- آنتالپی استاندارد سوختن تترا اتیل سرب: $$−19.29 kJ/g$$
- آنتالپی استاندارد تشکیل $${PbO(s)}$$ برابر است با $$−219.0 kJ/mol$$
برای حل این مساله، ابتدا معادله موازنه شده سوختن تترا اتیل سرب را مینویسیم.
$$begin{equation}
2 left ( mathrm {C} _ {2} mathrm {H} _ {5} right) _ {4} mathrm {Pb} (mathrm {l} ) + 27 mathrm {O } _ {2}(mathrm {g } ) rightarrow 2 mathrm {Pb O} (mathrm {s } ) + 16 mathrm {C O } _ {2} (mathrm { g } ) + 20 mathrm {H}_ {2} mathrm {O}( mathrm {l})
end{equation}$$
با استفاده از روابط گفته شده خواهیم داشت:
$$Delta H _{comb}^ {o} = left [ 2 Delta H _{f}^ {o}left ( P bO right ) + 16 Delta H _{f}^ {o} left ( C O _ {2} right ) + 20 Delta H _{f}^ {o} left ( H_ {2} O right ) right ] – left [2 Delta H_ {f}^ {o} left ( left ( C _{2} H_{5} right ) _ {4} Pb right ) + 27 Delta H_ {f}^ {o}left ( O _{2} right ) right ] nonumber$$
با حل رابطه بالا برای $$ΔH^o_f [{(C_2 H_5)_4 Pb}]$$ خواهیم داشت:
$$Delta H _ {f} ^ {o} left ( left ( C_ {2} H _ {5} right ) _ {4} Pb right ) =\ Delta H_ {f}^ {o}left ( Pb O right ) + 8 Delta H_ {f}^{o }left ( C O _{2} right ) + 10 Delta H _ {f}^ {o} left ( H_ {2} O right ) – dfrac {27}{2} Delta H_ {f}^{o} left ( O _{2} right ) – dfrac {Delta H_ {comb} ^ {o} }{2} nonumber$$
به غیر از $$ΔH^o_f [{(C_2 H_5)_4 Pb}]$$، مقادیر تمامی عبارات در رابطه بالا در جداول ترمودینامیکی موجود است.
مقدار $$ΔH^o_{comb}$$ در سوال به صورت کیلوژول بر گرم داده شده است و باید این مقدار را در جرم مولی تترا اتیل سرب $$(323.44 g/mol)$$ ضرب کنیم تا $$ΔH^o_{comb}$$ بر اساس ۱ مول تترا اتیل سرب بدست بیاید:
$$Delta H _{comb} ^ {o} = left ( dfrac {-1929 ; k J } {cancel {g} } right ) left ( dfrac {323.44 ; cancel {g}} {mol} right ) = -6329 ; k J / mol nonumber$$
با توجه به اینکه معادله موازنه شده شامل ۲ مول تترا اتیل سرب است، $$ΔH^o_{rxn}$$ برابر خواهد بود با
$$Delta H _ { rxn}^ {o} = 2 ; cancel {mol ; left ( C_ {2} H {5}right ) _ 4 Pb} left ( dfrac {-6329 ; kJ } {1 ; cancel {mol ; left ( C_{2} H {5} right ) _ 4 Pb }} right ) = -12,480 ; nonumber k J nonumber$$
با جایگذری مقادیر مناسب در رابطه، برای محاسبه $$ΔH^o_f [{(C_2 H_5)_4 Pb}]$$ خواهیم داشت:
$$begin{matrix}
Delta H _{f}^{o} left [ left (C _{2}H_{4} right )_ {4}Pb right ] & = & left [1 ; mol ;P b O ;times 219.0 ;kJ/mol right ] + left [8 ; mol ;CO_{2} times left (-393.5 ; kJ/mol right )right ] \
& & + left [10 ; mol ; H_{2}O times left ( -285.8 ; kJ/mol right ) right ] + left [-27/2 ; mol ; O_{2}) times 0 ; kJ/mol ; O_{2}right ] \
& & left [12,480.2 ; kJ/mol ; left ( C _{2} H_{5} right )_{4} Pb right ]\
& = & -219.0 ; kJ -3148 ; kJ – 2858 kJ – 0 kJ + 6240 ; kJ = 15 kJ/mol
end{matrix} nonumber$$
جمعبندی
در ادامه، به طور خلاصه، موارد مطرح شده را بازگو میکنیم:
- شرایط استاندارد برای اندازهگیری و گزارش آنتالپیهای تشکیل، فشار ۱ اتمسفر و دمای ۲۵ درجه سانتیگراد است.
- پایدارترین حالت اتم در شرایط استاندارد را به عنوان آنتالپی استاندارد تشکیل برابر با صفر در نظر میگیرند.
آنتالپی تشکیل $$(Delta H _f)$$ به تغییرات آنتالپی به هنگام تشکیل یک ترکیب از عناصر سازنده آن میگویند. آنتالپی استاندارد تشکیل $$((Delta H ^ circ _f))$$ را در شرایط استاندارد تعیین میکنند. این شرایط استاندارد عبارتست از فشار ۱ اتمسفر برای گازها و غلظت ۱ مولار برای ذرات موجود در محلول به شرطی که تمامی مواد خالص در شرایط استاندارد خود قرار داشته باشند. آنتالپی استاندارد واکنش $$(Delta H ^ circ _{rxn})$$ را میتوان از مجموع آنتالپیهای استاندارد تشکیل فرآوردهها (هرکدام ضربدر ضریب استوکیومتری) منهای مجموع آنتالپیهای استاندارد تشکیل واکنشدهندهها (ضربدر ضریب استوکیومتری) محاسبه کرد. آنتالپی محلول $$(Delta H ^ circ _{soln})$$ به گرمای آزادشده یا جذب شده به هنگام انحلال مقدار مشخصی از حلشونده در مقدار مشخصی از حلال در فشار ثابت میگویند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش مبانی سنتز در شیمی آلی
- عدد آووگادرو — به زبان ساده
- حجم مولی — به زبان ساده
نوشته آنتالپی استاندارد تشکیل — از صفر تا صد اولین بار در مجله فرادرس. پدیدار شد.
مطالب درسی...برچسب : نویسنده : خنجی darsi بازدید : 575
آرشیو مطالب
- مرداد 1392
- دی 1394
- بهمن 1394
- فروردين 1395
- ارديبهشت 1395
- خرداد 1395
- تير 1395
- بهمن 1396
- اسفند 1396
- شهريور 1396
- دی 1397
- بهمن 1397
- ارديبهشت 1397
- تير 1397
- آبان 1397
- آذر 1397
- دی 1398
- بهمن 1398
- اسفند 1398
- ارديبهشت 1398
- مرداد 1398
- مهر 1398
- آذر 1398
- دی 1399
- بهمن 1399
- اسفند 1399
- فروردين 1399
- خرداد 1399
- تير 1399
- مرداد 1399
- شهريور 1399
- مهر 1399
- بهمن 1400
- اسفند 1400
- فروردين 1400
- ارديبهشت 1400
- خرداد 1400
- تير 1400
- مرداد 1400
- دی 1401
- بهمن 1401
- اسفند 1401
- فروردين 1401
- ارديبهشت 1401
- خرداد 1401
- تير 1401
- مرداد 1401
- شهريور 1401
- مهر 1401
- آبان 1401
- آذر 1401
- دی 1402
- بهمن 1402
- اسفند 1402
- فروردين 1402
- ارديبهشت 1402
- خرداد 1402
- تير 1402
- مرداد 1402
- شهريور 1402
- مهر 1402
- آبان 1402
- آذر 1402
- فروردين 1403
- ارديبهشت 1403

