با حرارت دادن یک مایع، انرژی جنبشی متوسط اجزای آن افزایش مییابد. هرقدر مولکولهای بیشتری از سطح مایع به فاز بخار برسند، سرعت تبخیر افزایش مییابد. در نهایت، به نقطهای میرسیم که تمامی مولکولها در مایع، انرژی جنبشی کافی را برای تبخیر دارند. در این حالت، مایع شروع به جوشیدن میکند. نقطه جوش، به دمایی میگویند که در آن، فشار بخار یک مایع با فشار محیط برابر شود. در نتیجه، نقطه جوش یک مایع، به فشار اتمسفر وابسته است. هرقدر این فشار کمتر شود، نقطه جوش نیز پایینتر خواهد بود. به طور مثال، در سطح دریا، نقطه جوش آب، 100 درجه سانتیگراد است اما در ارتفاع 2000 متری از سطح دریا، این دما به 93/4 درجه سانتیگراد میرسد.
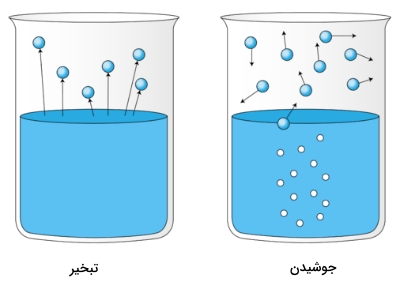
تصویر زیر، تبخیر یک مایع را نشان میدهد. در تصویر سمت چپ، مایع، پایینتر از دمای نقطه جوش قرار دارد اما در این حالت نیز، مقداری از مایع تبخیر میشود. در تصویر سمت راست، دما افزایش پیدا میکند تا اینکه حبابهایی در مایع تشکیل شوند. زمانی که فشار بخار در داخل حباب، با فشار محیط (فشار خارجی) برابر شود، حبابها با رسیدن به سطح مایع، از آن خارج میشوند. به دمایی که این فرآیند اتفاق بیوفتد، نقطه جوش مایع میگویند.
نقطه جوش نرمال
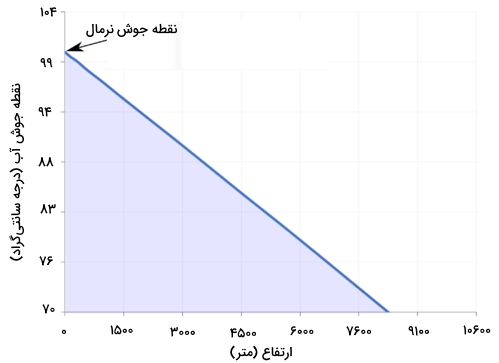
«نقطه جوش نرمال» (Normal Boiling Point)، دمایی است که در آن، فشار بخار مایع با فشار استاندارد برابر است. با توجه به اینکه، فشار اتمسفری در محلهای مختلف تغییر میکند، این دما نیز با تغییر فشار، متغیر خواهد بود اما نقطه جوش نرمال، ثابت است زیرا بر اساس فشار استاندارد ۷۶۰ میلیمتر جیوه (۱ اتمسفر) تعریف شده است. تصویر زیر، تغییرات ارتفاع و اثر آن بر نقطه جوش را نشان میدهد. خوب است بدانید که نقطه جوش نرمال را با نامهای دیگری همچون نقطه جوش اتمسفری و نقطه جوش فشار اتمسفری هم تعریف میکنند.
دو تعریف مختلف از نقطه جوش وجود دارد. نقطه جوش نرمال در فشار ۱ اتمسفر یا $$101.325 kPa$$ برابر با 99/97 درجه سانتیگراد است. در تعریف آیوپاک، «نقطه جوش استاندارد آب» (Standard Boiling Point of Water) در فشار استاندارد $$100 kPa$$، 99/61 درجه سانتیگراد ذکر میشود.
دما و فشار اشباع
یک مایع اشباع، به اندازهای انرژی حرارتی دارد که بیشتر از آن، شروع به جوشیدن میکند. به این نقطه، «دمای اشباع» (Saturation Temperature) نیز میگویند. در تعریفی دیگر، دمای اشباع، به دمای متناظر با فشار اشباعی میگویند که در آن دما، مایع به فاز بخار تبدیل میشود.
دمای اشباع
اگر شرایط همفشار داشته باشیم، یعنی فشار در یک سیستم، ثابت بماند، بخار در دمای اشباع، با خارج شدن گرما، شروع به میعان به فاز مایع میکند. به طور مشابه، اگر به مایعی در دما و فشار اشباع، انرژی حرارتی (گرما) بدهیم، به فاز بخار میرود.
همانطور که در بالا نیز به آن اشاره شد، نقطه جوش، متناظر با دمایی است که در آن، فشار بخار مایع، با فشار محیط اطراف برابر شود. در نتیجه نقطه جوش، به فشار وابسته است. در ارتفاعات بالاتر، جایی که فشار اتمسفری کمتر باشد، دمای جوش کاهش پیدا میکند. با افزایش فشار، نقطه جوش نیز تا نقطهای موسوم به «نقطه بحرانی» (Critical Point)، افزایش پیدا میکند. در این نقطه، خواص گاز و مایع با یکدیگر برابرند.
بعد از نقطه بحرانی، نمیتوان نقطه جوش را افزایش داد. به طور مشابه، دمای جوش با کاهش فشار، تا «نقطه سهگانه» (Triple Point) کاهش پیدا میکند و بعد از آن، نمیتوان نقطه جوش را کاهش داد. اگر گرمای تبخیر (آنتالپی تبخیر) و فشار بخار یک مایع را داشته باشیم، نقطه جوش را به کمک «رابطه کلازیوس-کلاپیرون» (Clausius-Clapeyron) میتوان محاسبه کرد:
$$T_{mathrm{B}}=left(frac{1}{T_{0}}-frac{R ln frac{P}{P_{0}}}{Delta H_{mathrm{vap}}}right)^{-1}$$
- $$T_B$$: نقطه جوش در فشار مورد نظر
- $$R$$: ثابت گازهای ایدهآل
- $$P$$: فشار بخار مایع در فشار مورد نظر
- $$P_0$$: فشار متنظر با دمای $$T_0$$
- $$Delta H _ {vap}$$: آنتالپی تبخیر مایع
- $$T_0$$: دمای جوش
همچنین، این رابطه را به شکل زیر نیز میتوان تعریف کرد به طوریکه اگر $$P_1$$ و $$P_2$$، فشار بخار در دو دمای $$T_1$$ و $$T_2$$ باشند، خواهیم داشت:
$$ln left( dfrac{P_1}{P_2} right) = dfrac{Delta H_{vap}}{R} left( dfrac{1}{T_2}- dfrac{1}{T_1} right)$$
یا
$$ln left( dfrac{P_1}{P_2} right) = – dfrac{Delta H_{vap}}{R} left( dfrac{1}{T_1}- dfrac{1}{T_2} right) label{2B} nonumber$$
مثال
فشار بخار آب در دمای 373 کلوین، 1 اتمسفر و آنتالپی تبخیر آن، $$40.7 KJ/mol$$ است. فشار بخار را در دماهای 363 و 383 کلوین محاسبه کنید.
با استفاده از رابطه کلازیوس-کلاپیرون خواهیم داشت:
$$begin{align} P_{363} &= 1.0 exp left[- left(dfrac{40,700}{8.3145}right) left(dfrac{1}{363;K} -dfrac{1}{373; K}right) right] nonumber \[4pt] &= 0.697; atm nonumber end{align} nonumber$$
$$begin{align} P_{383} &= 1.0 exp left[- left( dfrac{40,700}{8.3145} right)left(dfrac{1}{383;K} – dfrac{1}{373;K} right) right] nonumber \[4pt] &= 1.409; atm nonumber end{align} nonumber$$
توجه داشته باشید که تغییر فشار بخار به ازای تغییر دما از ۳۷۳ به ۳۶۳ کلوین، برابر با 0/303 اتمسفر بود اما افزایش دمای 373 به ۳۸۳ کلوین، فشار بخار را به میزان 1/409 اتمسفر افزایش داد، در نتیجه، افزایش فشار بخار به صورت خطی اتفاق نمیافتد.
فشار اشباع
فشار اشباع، فشار متناظر با دمای اشباع است که در آن حالت، یک مایع میجوشد. علاوه بر این، فشار و دمای اشباع با یکدیگر رابطه مستقیم دارند، یعنی با افزایش فشار اشباع، دمای اشباع نیز افزایش مییابد.
اگر در یک سیستم، شرایط همدما داشته باشیم، به هنگام افزایش فشار سیستم، بخار در فشار و دمای اشباع، شروع به میعان به فاز مایع میکند. به طور مشابه، با کاهش فشار سیستم، مایع در فشار و دمای اشباع، به فاز بخار میرود که به این عمل به اصطلاح «تبخیر ناگهانی» (Flash Evaporation) یا فِلَش میگویند.

ارتباط بین نقطه جوش نرمال و فشار بخار مایعات
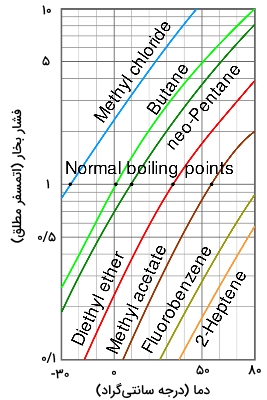
هر اندازه فشار بخار یک مایع در دمای خاص، بیشتر باشد، نقطه جوش نرمال آن پایینتر است. در تصویر زیر، نمودار فشار بخار بر حسب دما، برای مایعات مختلف دیده میشود. با دقت در نمودار، میتوان دریافت مایعاتی با بیشترین فشار بخار، کمترین نقطه جوش نرمال را دارند.
به طور مثال، در تمامی دماها، متیلکلرید، بیشترین فشار بخار را در بین مایعات این نمودار دارد. همچنین، در نقطه تقاطع با خط افقی نقطه جوش نرمال – یعنی خطی که نمودار را در فشار ۱ اتمسفر قطع میکند – کمترین نقطه جوش برابر با $$-24.2 C ^ circ$$ را دارد.
بیشترین و کمترین نقطه جوش
هلیوم، عنصری با کمترین نقطه جوش است. نقطه جوش «رنیوم» (Rhenium) و تنگستن در فشار استاندارد، بیش از 4700 درجه سانتیگراد ذکر میشود. با توجه به اینکه، اندازهگیری دما برای دماهای بسیار زیاد، با تصحیحاتی همراه است، این دو عنصر، هردو به عنوان عناصری با بالاترین نقطه جوش در منابع علمی آورده شدهاند.
عوامل موثر بر نقطه جوش
همانطور که در تصویر بالا دیده میشود، نقطه جوش نرمال را میتوان نشانی از فراریت یک ترکیب دانست. یک ترکیب خالص، تنها یک نقطه جوش نرمال دارد. هر اندازه که نقطه جوش نرمال یک ماده بیشتر باشد، فراریت آن کمتر است. برخی از مواد، قبل از آنکه به نقطه ذوب یا جوش خود برسند، تجزیه میشوند. برای یک ماده پایدار، بسته به فشار محیط، نقطه جوش، دامنهای بین نقطه سهگانه و نقطه بحرانی دارد. لازم به ذکر است که در بالای نقطه سهگانه، نقطه جوش نرمال یک ترکیب، بالاتر از نقطه ذوب آن قرار دارد.
بالاتر از نقطه بحرانی، مایع و بخار به یک فاز تبدیل میشوند و به آن، «گاز فوق گرم» (Super Heated Gas) میگویند. با توجه به تعریف نقطه جوش نرمال، میتوان گفت در هر دمایی که بالاتر از نقطه جوش نرمال باشد، ترکیب مورد نظر در فشار اتمسفری، به حالت گاز قرار دارد.
اگر نقطه جوش نرمال، بالاتر باشد، در این حالت، ترکیب مورد نظر میتواند به حالت مایع یا جامد دیده شود. توجه داشته باشید که در این شرایط، فشار محیط را فشار اتمسفری در نظر گرفتهایم. اگر ترکیب مورد نظر، فرار باشد، در صورت وجود بخار، تحت چنین شرایطی، ترکیب با بخار خود به حالت تعادل قرار دارد.

پیوندهای شیمیایی و دمای جوش
به طور کلی، ترکیبات با پیوند یونی، نقطه جوش بالاتری دارند. البته این امر زمانی صحت دارد که ترکیب مورد نظر، قبل از جوشیدن، تجزیه نشود. همچنین، بیشتر فلزات، نقطه جوش بالایی دارند. به طور کلی، در ترکیباتی که پیوند کووالانسی دارند، با افزایش اندازه مولکول یا جرم مولی آن، نقطه جوش نرمال افزایش مییابد. البته زمانی که اندازه مولکولی به اندازه یک «درشت مولکول» (Macromolecule) یا پلیمر نزدیک شود، ترکیب مورد نظر، قبل از رسیدن به نقطه جوش، تجزیه میشود.
تاثیر قطبیت مولکولها بر دمای جوش
عامل دیگری که بر دمای جوش در یک ترکیب تاثیر میگذارد، قطبیت مولکولهای آن است. با افزایش قطبیت مولکول، دمای این نقطه نیز افزایش مییابد. همچنین توانایی یک مولکول برای تشکیل پیوند هیدروژنی هم از عوامل تاثیرگذار بر این نقطه به شمار میآید چراکه خارج شدن از حالت مایع را برای مولکول دشوار میکند. به عنوان نمونه میتوان به کربوکسیلیک اسید اشاره کرد که بین مولکولهای خود با دیمر شدن، پیوند هیدروژنی تشکیل میدهد.
شکل مولکول
شکل مولکول نیز بر دمای جوش تاثیرگذار است. هر قدر شکل مولکول فشردهتر باشد، نقطه جوش پایینتری خواهیم داشت. جدول زیر، مقایسه بین نقطه جوش نرمال بوتان و ایزو بوتان را نشان میدهد. علاوه بر این، در جدولی دیگر، دمای جوش ان-پنتال، ایزو پنتان و نئوپنتان با یکدیگر مقایسه شده است.
| نام معمول | نرمال بوتان (ان-بوتان) | ایزو بوتان |
| نام آیوپاک | بوتان | ۲-متیل پروپان |
| شکل مولکول | 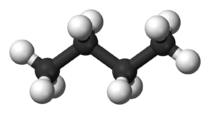 | 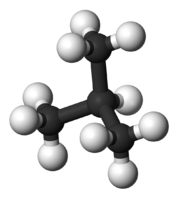 |
| نقطه جوش (درجه سانتیگراد) | $$-0.5$$ | $$-11.7$$ |
| نام معمول | ان-پنتان | ایزوپنتان | نئوپنتان |
| نام آیوپاک | پنتان | ۲-متیل بوتان | 2 و 2- دیمتیل پروپان |
| شکل مولکولی | 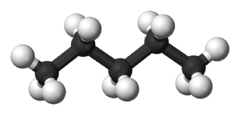 | 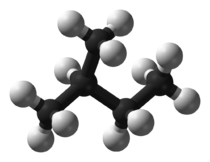 | 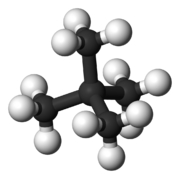 |
| نقطه جوش (درجه سانتی گراد) | $$36$$ | $$27.7$$ | $$9.5$$ |
بسیاری از ترکیبات فرار، به هنگام گرم شدن، به یک فاز واسط مایع میروند و در نهایت، از جامد به گاز تبخیر میشوند. در مقایسه با جوشیدن، تصعید نوعی تغییر فیزیکی است که در آن، جامد به طور مستقیم به بخار تبدیل خواهد شد. این حالت، تنها در برخی موارد خاص روی میدهد که از میان آنها میتوان به دیاکسید کربن در فشار اتمسفر اشاره کرد. برای چنین ترکیباتی، «نقطه تصعید» (Sublimation Point) جایی است که ماده مورد نظر، فشار بخاری برابر با فشار محیط دارد.
ناخالصیها و مخلوطها
وجود ناخالصی (مواد حلشونده) و سایر اجزای امتزاجناپذیر، فشار بخار و به تبع آن نقطه جوش مواد را تحت تاثیر قرار میدهند. درجه این تاثیر، به غلظت ناخالصی بستگی دارد. وجود ناخالصیهای غیرفرار همچون نمکها، یا ترکیباتی فرار با مقداری بسیار کمتر از جزء اصلی ترکیب، میزان کسر مولی ترکیب و فراریت آنرا کاهش میدهند، در نتیجه دمای جوش افزایش پیدا میکند. به طور مثال، آبنمک، در دمایی بالاتر از دمای جوش آب، به جوش میآید.
در سایر ترکیبات امتزاجپذیر، ممکن است یک یا چند جزء با فراریت متفاوت وجود داشته باشند. وجود اجزای فرار در یک مخلوط، بر فشار بخار، نقطه جوش و «نقطه شبنم» (Dew Point) تمامی اجزا در مخلوط تاثیرگذار است. نقطه شبنم، به دمایی میگویند که در آن دما، بخار به مایع تبدیل میشود. علاوه بر این، در دماهای مختلف، ترکیب بخار، با ترکیب مایع تفاوت دارد. به منظور نمایش این نوع از تاثیرات ترکیبات فرار در یک مخلوط، به طور معمول از نمودار نقطه جوش استفاده میکنند. لازم به ذکر است که در فرآیند تقطیر، از همین ویژگی تفاوت نقطه جوش مواد در مخلوط بهره میگیرند و به کمک آن، مواد مختلف در یک مخلوط را از یکدیگر جدا میکنند.
بررسی دقیقتر عوامل تاثیرگذار بر نقطه جوش
پیشتر در خصوص تاثیر پیوندهای مخلتف و نیروهای بین مولکولی بر نقطه جوش مواد صحبت کردیم. در ادامه قصد داریم تا این مفهوم را به طور دقیقتری بررسی کنیم. برای فهمیدن ترتیب نقطه جوش مواد، نیاز به درک روندهای حاکم بر پیوندهای بین مولکولی داریم. نکته اصلی در اینجا نهفته است که دمای جوش را میتوان بازتابی از قدرت پیوندهای بین مولکولی دانست. هرقدر این مولکولها، با قدرت بیشتری با یکدیگر پیوند تشکیل داده باشند، با دشواری بیشتری میتوان آنها را به فاز گاز منتقل کرد. سه روند مهم را در خصوص نقطه جوش مواد باید در نظر گرفت:
- قدرت نسبی نیروهای بینمولکولی: یونی > پیوند هیدروژنی > دو قطبی-دوقطبی> نیروهای پراکندگی واندروالس
- افزایش نقطه جوش با افزایش تعداد اتمهای کربن
- کاهش نقطه جوش با شاخهدار شدن ترکیبات
قدرت نسبی نیروهای بین مولکولی
در تصویر زیر، مولکولهای دیاتیل اتر، ان-بوتانول و سدیم ان-بوتاکسید را مشاهده میکنید. مولکولهای دیاتیل اتر، توسط برهمکنشهای دوقطبی-دوقطبی در کنار یکدیگر قرار گرفتهاند. نقطه جوش این ماده را با ایزومر آن، بوتانول مقایسه کنید. دلیل افزایش نقطه جوش، وجود گروه هیدروکسیل در بوتانول است که میتواند با سایر مولکولها پیوند هیدروژنی بدهد. با این وجود، نقطه جوش این ترکیب نیز بسیار کمتر از سدیم ان-بوتاکسید است. این ماده در دمایی پایینتر از 260 درجه سانتیگراد ذوب و قبل از رسیدن به دمای جوش خود، تجزیه میشود.

اما در خصوص مولکول بوتان با فرمول $$C_4H_{10}$$ باید بگوییم که هیچ گروه عاملی قطبی در آن وجود ندارد و تنها نیروهای جاذبه موجود بین مولکولهای آن، نیروهای ضعیف پراکندگی واندروالس هستند. در نتیجه، دمای جوش این ماده، دمای صفر درجه، برابر با نقطه ذوب آب و بسیار پایینتر از حتی دیاتیل اتر است. به عبارت دیگر، در بین مولکولهایی با وزن مولکولی مشابه، حضور گروههای عاملی تعیین کننده ترتیب دمای جوش خواهد بود.
وزن مولکولی
به تصویر زیر نگاه کنید. در تمامی مولکولهای این تصویر، با افزایش وزن مولکولی، نقطه جوش نیز افزایش پیدا میکند.
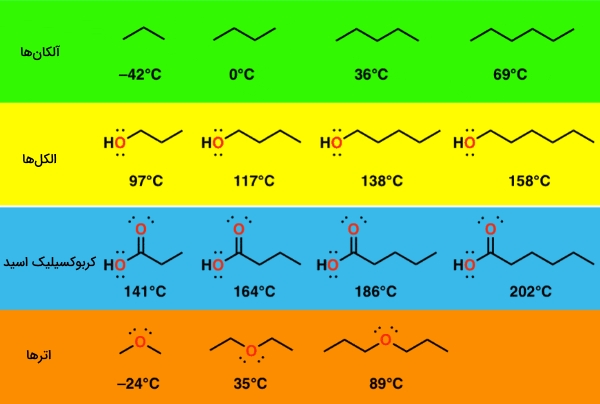
نیروی اصلی غالب در این شرایط، نیروهای پراکندگی واندروالس هستند. قدرت این نیروها تابعی از مساحت مولکول هم هست، به گونهای که با افزایش طول زنجیر کربنی، مساحت این مولکولها افزایش پیدا میکنند. با افزایش طول زنجیر، جاذبه هر مولکول نیز افزایش مییابد که در نهایت، سبب افزایش نقطه جوش میشود.
تقارن
هرقدر شکل مولکول خطیتر باشد، دمای جوش بالاتری خواهیم داشت. در مقابل، هرقدر شکل مولکول، حالتی کروی داشته باشد، مساحت کمتری را شامل میشود و در نتیجه، نیروهای واندروالس ضعیفتری داریم که نتیجه آن، نقطه جوش کمتر است. در تصویر زیر میتوانید شاخهدار شدن مولکول و تاثیر آن بر دمای جوش را ملاحظه کنید. همچنین، تاثیر گروههای عاملی قطبی در نقطه جوش هم در تصویر زیر دیده میشود.
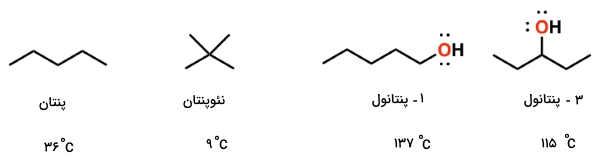
در خصوص گروههای عاملی قطبی نیز باید گفت، هر قدر این گروهها، سادهتر پیوند هیدروژنی تشکیل دهند، دمای جوش بالاتری خواهیم داشت. به طور مثال، با مقایسه ۱-پنتانول و ۳-پنتانول، در مییابیم که در ۳-پنتانول، گروه هیدروکسیل توسط دو گروه آلکیلی احاطه شده است اما چنین مشکلی برای ۱-پنتانول وجود ندارد. در نتیجه، دمای جوش ۱-پنتانول قدری بیشتر از ۳-پنتانول خواهد بود.
به طور خلاصه، سه عامل اصلی در خصوص نقطه جوش ترکیبات آلی مد نظر است:
- نوع برهمکنش بین مولکولها
- مقایسه وزن مولکولی
- نوع تقارن مولکولی
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- تغییر فیزیکی — به زبان ساده
- پیرولیز — به زبان ساده
^^