- سوالات استخدامی نقاشی ایرانی از دیروز تا امروز (دبیر فرهنگ و هنر)
- سوالات استخدامی هنر و تمدن اسلامی (دبیر فرهنگ و هنر)
- سوالات استخدامی دبیری فرهنگ و هنر با پاسخنامه (حیطه تخصصی)
- تولید صابون از پلاستیک های دور ریز
- پنج توصیه ویژه برای والدینی که فرزندشان کنکوری است
- مهروماه در سی و پنجمین نمایشگاه کتاب تهران
- سوالات ضمن خدمت محور مهارت های فردی و اجتماعی ( زندگی با قرآن و عترت و آشنایی با حکمت های نهج البلاغه ) سال ۱۴۰۳
- پاورپوینت گل های آپارتمانی
- پاورپوینت گل های آپارتمانی زینتی
- سوالات استخدامی راهنمای معلم فرهنگ و هنر (دبیر فرهنگ و هنر)
آخرین مطالب
امکانات وب
انواع ایزومری در شیمی از تفاوت در آرایش و جهتگیری اتمها و گروههای در یک مولکول به وجود میآیند و باعث ایجاد تفاوت در ویژگیهای شیمیایی و فیزیکی مولکولها میشوند. برای مثال بسیاری از ترکیبات دارویی دارای ایزومرهایی هستند که ویژگیهایی کاملا متفاوت نسبت به آنها از خود نشان میدهند. از آنجا که مفهوم ایزومری در بسیاری از ترکیبات به چشم میخورد، بنابراین دانشجویان شیمی و افراد فعال در این حوزه باید توانایی شناسایی انواع ایزومری و تشخیص آنها از یکدیگر را داشته باشند.
در این مطلب از مجله فرادرس ابتدا میخواهم با مفهوم ایزومر آشنا شویم و سپس انواع ایزومری شامل ایزومر کنفورماسیونی، ایزومر هندسی، ایزومر نوری و تعداد بیشتر از آنها را مورد بررسی قرار میدهیم. در هر مورد مولکولهایی آورده شده است که به درک مفهوم کمک قابل توجهی میکند. در نهایت نیز به بررسی تعدادی مثال و حل تمرین چندگزینهای از انواع ایزومری پرداختهایم.
ایزومر چیست؟
«ایزومرها» (Isomers) مولکولهایی با فرمول مولکولی یکسان هستند که نوع آرایش و جهتگیری اتمها در آنها با یکدیگر متفاوت است. این پدیده یکی از جالبترین ویژگیهای شیمی آلی است که به دلیل سهبعدی بودن مولکولها مشاهده میشود.
شکل فضایی مولکولها میتواند روی ویژگیهایی که از خود نشان میدهند، تاثیر بهسزایی داشته باشد. انواع ایزومری متفاوتی وجود دارند که میتوانید آنها را در فلوچارت زیر مشاهده کنید. به کمک این جدول میتوانیم راحتتر در مورد رابطه دو مولکول با یکدیگر اظهار نظر کنیم.

انواع ایزومری چیست؟
در این بخش میخواهیم به معرفی انواع ایزومری موجود بپردازیم و هر کدام را به تفضیل مورد بررسی قرار دهیم. در هر مورد سعی کردهایم مثالهای متنوعی ارائه دهیم تا شناخت بهتری نسبت به انواع ایزومری پیدا کنیم.
ایزومر کنفورماسیونی
پیوند شیمیایی یگانه کربن کربن در اتان، پروپان و دیگر آلکانها از همپوشانی اوربیتال با هیبریداسیون $$sp^3$$ روی یک اتم کربن با اوربیتال با هیبریداسیون $$sp^3$$ در کربن دیگر و تشکیل پیوند سیگما به وجود میآیند. از آنجا که چرخش حول پیوند یگانه کربن کربن تغییری در همپوشانی اوربیتالها با هیبریداسیون $$sp^3$$ به وجود نمیآورد، سد انرژی قابلتوجهی برای انجام آن وجود ندارد.
در نتیجه چیدمانهای بسیاری برای اتمهای یک مولکول امکان وجود دارند که هر کدام مربوط به یکی از درجههای چرخش حول پیوند است. به هر کدام از این ساختارها که چیدمان متفاوتی از یکدیگر دارند، یک «ایزومر کنفورماسیونی» (Conformational Isomer) یا «کنفورمر» (Conformer) گفته میشود. در تصویر زیر میتوانید ساختار ۳ ایزومر کنفورماسیونی متفاوت از مولکول پنتان را مشاهده کنید.
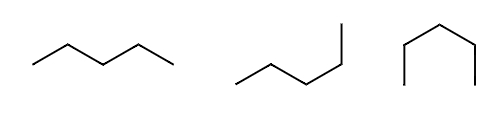
ایزومر ساختاری
برخلاف ایزومرهای کونفورماسیونی که در بخش قبل به آنها پرداختیم که در آنها نحوه اتصال اتمها فرقی نمیکند، «ایزومرهای ساختاری» (Structural Isomers) در نحوه اتصال نیز با یکدیگر متفاوت هستند. مثالی از انواع ایزومری ساختاری را میتوانید در تصویر زیر مشاهده کنید که مربوط به هیدروکربنی آلیفاتیک با ۳ اتم کربن است.
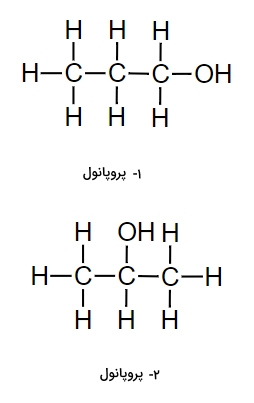
یکی از این ایزومرهای ساختاری ۱-پروپانول (نرمال پروپانول) و دیگری ۲-پروپانول (ایزوپروپانول) است که در هر دو، گروه عاملی الکل حضور دارد.گرچه فرمول مولکولی هر دوی آنها $$C_3H_8O$$ است اما در موقعیت گروه هیدروکسیل با یکدیگر متفاوت هستند. همین تفاوت باعث متفاوت بودن ویژگیهای فیزیکی و شیمیایی آنها نسبت به یکدیگر میشود.
توجه داشته باشید که در تبدیل یک ایزومر ساختاری به ایزومر ساختاری دیگر حداقل یک پیوند شکسته و پیوند دیگری در محل جدیدی از مولکول تشکیل میشود. برای مثال به انواع ایزومری ساختاری موجود در تصویر زیر نگاه کنید که مربوط به هیدروکربنی با فرمول شیمیایی $$C_5H_{12}$$ هستند.
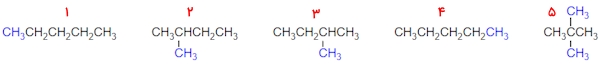
مشاهده میکنید که ساختار ۱ و ۴ در واقع مشابه هم هستند، همچنین ساختار ۲ و ۳ نیز یک مولکول واحد را نشان میدهند که با چرخش به میزان ۱۸۰ درجه به یکدیگر تبدیل میشوند. تنها سه مولکول را میتوان ایزومر ساختاری یکدیگر دانست، مولکول شماره ۱ و۴ با نام نرمال پنتان، مولکول شماره ۲ و ۳ با نام ۲-متیل بوتان و مولکول شماره ۵ با نام ۲و۲-دیمتیل پروپان.
برای تشخیص ایزومرهای ساختاری میتوانیم به شکست پیوندهای موجود توجه کنیم. برای مثال در تصویر بالا برای تبدیل مولکول شماره ۱ به ۴ و مولکول شماره ۲ به ۳ هیچ پیوندی شکسته نمیشود، بنابراین یکسان هستند و ویژگیهای فیزیکی و شیمیایی مشابهی نیز از خود بروز میدهند.
ایزومر فضایی
در «ایزومرهای فضایی» (Stereoisomers) نحوه اتصال اتمها به یکدیگر مشابه است اما در جهتگیری در فضای سهبعدی با هم تفاوتهایی دارند. با توجه به تفاوت جهتگیری در فضا ایزومر فضایی انواع متفاوتی خواهد داشت که در ادامه به بررسی آنها خواهیم پرداخت. این ایزومر را با ایزومر ساختاری مقایسه کنید که در آن نحوه اتصال اتمها با یکدیگر متفاوت بود.
ایزومر هندسی
«ایزومرهای هندسی» (Geonetric Isomers) که با نام «ایزومر پیکربندی» (Configurational Isomer) یا «ایزومر سیس و ترانس» (Cis and Trans Isomer) نیز شناخته میشوند، زیر مجموعه ایزومرهای فضایی هستند. در این ایزومرها، ترتیب اتصال اتمها مشابه است اما در آرایش فضایی اتمها تفاوتهایی مشاهده میشود. میدانیم که پیوندهای دوگانه در آلکنها به دلیل ماهیت صلب خود، آزادی چرخش ندارند.
برای مثال به آلکن ۲-بوتن توجه کنید که در آن یک پیوند دوگانه بین کربن شماره ۲ و ۳ برقرار است که بین دو پیوند یگانه وجود دارد. این پیوند دوگانه صلب میتواند باعث به وجود آمدن دو ایزومر متفاوت از ۲-بوتن شود که آنها را در تصویر زیر مشاهده میکنید.
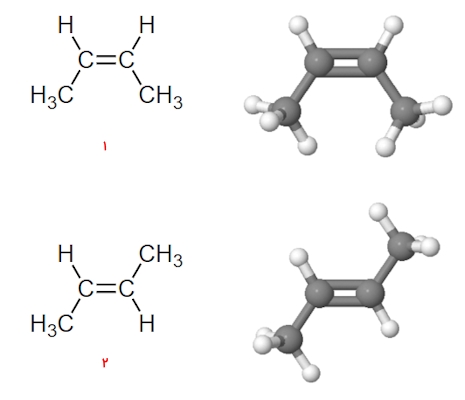
در این ایزومری بسته به جهتگیری استخلافها نسبت به پیوند دوگانه دو ایزومر سیس و ایزومر ترانس را مشاهده میکنیم. در تصویر بالا مولکول شماره ۱ سیس بوتن و مولکول شماره ۲ ترانس بوتن نامیده میشود. در ایزومر سیس دو اتم هیدروژن در یک سمت مولکول قرار دارند در حالی که در ایزومر ترانس در دو سمت مختلف هستند.
توجه داشته باشید که تنها مولکولهایی دارای ایزومر سیس و ترانس هستند که ساختاری صلب، مانند پیوند دوگانه و حلقه داشته باشند که در آنها امکان چرخش حول پیوند وجود نداشته باشد. به علاوه برای سیس و ترانس بودن ایزومر، اتمهای کربن باید دارای دو گروه متفاوت به خود باشند. برای مثال به تصویر زیر که مربوط به مولکول پروپن است، توجه کنید.
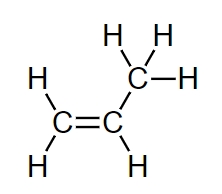
همانطور که مشاهده میکنید در این ساختار ایزومر هندسی وجود ندارد زیرا یکی از اتمهای کربن درگیر در پیوند دوگانه تنها به ۲ اتم هیدروژن متصل است. بهطور کلی ویژگیهای فیزیکی و شیمیایی ایزومرهای هندسی از یکدیگر متفاوت است.
از جمله ترکیبات صلب دیگری که دارای ایزومر ساختاری هستند، میتوان به آلکینها اشاره کرد. مثالی از این ایزومر را در تصویر زیر مشاهده میکنید که در آنها جایگاه پیوند سهگانه با یکدیگر متفاوت است.
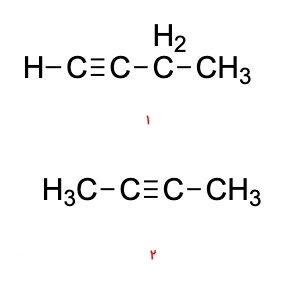
همانطور که مشاهده میکنید مولکول شماره ۱ با نام ۱-بوتین و مولکول شماره ۲ با نام ۲-بوتین، ایزومر ساختاری یکدیگر هستند. با این حال نمیتوانند ایزومر هندسی داشته باشند زیرا به کربنهای درگیر در پیوند سهگانه تنها ۱ گروه متصل است.
ایزومر نوری
ایزومرهای فضایی که ایزومر هندسی نیستند، میتوانند «ایزومرهای نوری» (Optical Isomers) را به وجود آورند. ایزومرهای نوری ایزومرهایی هستند که در جایگاه استخلافهای حول یک اتم یا مولکول با یکدیگر متفاوت باشند. به دلیل برهمکنش این ایزومرها با «نور قطبیده» (Plane Polarized Light) آنها را نوری مینامیم و به دو دسته مهم انانتیومر و دیاسترومر طبقهبندی میشوند که در ادامه به هر کدام خواهیم پرداخت.
انانتیومر چیست؟
«انانتیومرها» (Enantiomers) تصویر آینهای یکدیگر هستند اما بر هم منطبق نمیشوند. سادهترین مثالی که میتوان از انانتیومرها زد دستهای انسان است. دست راست و چپ انسان تصویر آینهای یکدیگر هستند اما در صورتی که کف هر دو دست به سمت بالا یا پایین باشد، نمیتوان آنها را بر هم منطبق کرد. این نکته را میتوانید در تصویر زیر مشاهده کنید.
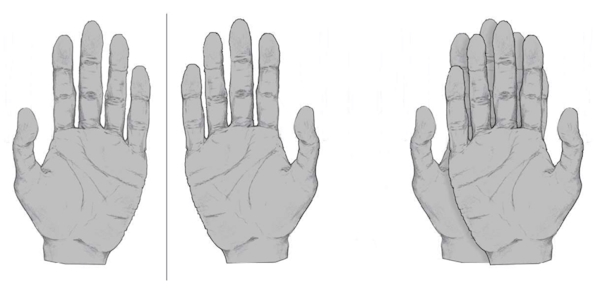
به اشیاء انطباقناپذیری که تصویر آینهای یکدیگر باشند، «کایرال» (Chiral) میگوییم. یکی از روشهای ساده برای پی بردن به کایرال بودن یک مولکول ساده این است که گروههای مختلف متصل به اتم مرکزی کربن را بررسی کنیم. در صورتی که روی کربن، ۴ گروه متفاوت حضور داشته باشد آن را کایرال در نظر میگیریم. برای مثال به مولکول زیر توجه کنید.
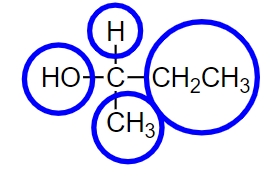
همانطور که مشاهده میکنید به کربن مرکزی این مولکول، ۴ گروه مختلف $$H$$ و $$OH$$ و $$CH_3$$ و $$CH_2CH_3$$ متصل است که با دایرههایی به رنگ آبی مشخص شدهاند، بنابراین کربن مرکزی آن را کایرال مینامیم.
کایرالیته چیست؟
«کایرالیته» (Chirality) مفهومی است که به مولکولهایی با توانایی چرخش نور قطبیده نسبت داده میشود و این ویژگی در تمامی ایزومرها مانند ایزومرهای هندسی وجود ندارد. در این صورت هر مولکولی که توانایی چرخش نور قطبیده را داشته باشد، «کایرال» (Chiral) نامیده میشود و تصویر آینهای نیز دارد.
در هر مولکول کایرال، اتمی چهاروجهی وجود دارد که روی خود دارای ۴ استخلاف یا اتم متفاوت است و با نام «مرکز فضایی» (Stereocenter) یا «مرکز کایرال» (Chiral Center) نامیده میشود. از این نکته میتوان برای شناسایی مولکولهای کایرال و رابطه بین آنها استفاده کرد.
مخلوط راسمیک چیست؟
«مخلوط راسمیک» (Racemic Mixture) ترکیبی با نسبت ۱:۱ از دو انانتیومر است. از آنجا که دو انانتیومر دارای چرخش نوری با مقدار برابر و در جهت مخالف هستند، مخلوط راسمیک فاقد فعالیت نوری است.
تعیین پیکربندی
برای نامگذاری و تعیین انانتیومرهای یک ترکیب باید نوع دستسانی آنها را در مولکول بیان کنیم. این روش به نام روش $$R$$ و $$S$$ شناخته میشود که نخستین بار توسط سه دانشمند به وجود آمد و با توجه به نامهای آنها بهصورت «قانون کان اینگولد پرولوگ» (Cahn Ingold Prelog Rules) نامگذاری شد. در ادامه میخواهیم با این قانون برای تعیین پیکربندی انواع ایزومری آشنا شویم.
در این روش مراکز فضایی ایزومرهای نوری با $$S$$ و $$R$$ تعیین میشوند. در صورتی که در مرکزی فضایی اولویت استخلافها را تعیین کنیم و فلشی از استخلاف بالا به استخلافهای پایین رسم کنیم و جهت آن ساعتگرد باشد، پیکربندی آن از نوع $$R$$ است. همچنین در صورتی که جهت حرکت فلش بهصورت پادساعتگرد باشد، آن را با $$S$$ مشخص میکنیم.
این مورد را میتوانید در تصویر زیر مشاهده کنید. شماره ۱ نشاندهنده استخلاف با بیشترین اولویت و شماره ۴ نشاندهنده استخلاف با کمترین اولویت است. این پیکربندیها بهصورت پسوندی درون پرانتز پیش از نام مولکولها با مراکز فضایی آورده میشوند.

قوانین اولویت استخلافها
همانطور که مشاهده کردید یکی از مهمترین مواردی که باید برای تخصیص پیکربندی انجام دهیم، تعیین اولویت استخلافها است. در این بخش میخواهیم نحوه آن را فرا گیریم. توجه داشته باشید که در صورت اولویتگذاری نادرست، پیکربندی به دست آمده نیز صحیح نخواهد بود، بنابراین باید به این قوانین تسلط کافی پیدا کنیم.
قانون اول
ابتدا اتمهایی که بهصورت مستقیم به مراکز فضایی متصل هستند را مورد بررسی قرار میدهیم. اتمی با عدد اتمی بالاتر نسبت به اتمی با عدد اتمی پایینتر از اولویت بالاتری برخوردار است. در این صورت اتم هیدروژن کمترین اولویت را در عناصر جدول تناوبی دارد زیرا عدد اتمی آن برابر با ۱ است.
- در صورتی که شاهد حضور ایزوتوپها باشیم، ایزوتوپی که بالاترین جرم اتمی را دارد بیشترین اولویت را خواهد داشت.
- نکته مهمی که وجود دارد این است که استخلاف با کمترین اولویت باید همیشه دور از بیننده باشد که با نقطهچین آن را مشخص میکنیم. برای درک بهتر ساعتی را تصور کنید که از روبرو به آن نگاه میکنیم. استخلاف با اولویت پایینتر مانند عقربهای است که در پشت صفحه ساعت قرار دارد.
- پس از تخصیص اولویت به استخلافها، از استخلاف با اولویت ۱ به اولویت ۲ و سپس به اولویت ۳ فلشی رسم میکنیم. در این صورت اگر جهت فلش ساعتگرد باشد، پیکربندی از نوع $$R$$ و در صورتی که پادساعتگرد باشد، پیکربندی از نوع $$S$$ است.
توجه داشته باشید که پیش از رسم فلش، باید استخلاف با کمترین اولویت در پشت صفحه و با نقطهچین باشد. همچنین استخلاف با اولویت بالاتر باید در روی صفحه و با گوه مشخص شده باشد. در صورتی که غیر از باشد، باید آن را بچرخانیم تا به پیکربندی صحیح برسیم.
قانون دوم
در صورتی که در استخلافی اولین اتم متصل یکسان باشد، به سراغ اتمهای متصل به آن میرویم. در این مورد با یافتن اولین تفاوت بین دو استخلاف میتوانیم به تخصیص اولویت آنها بپردازیم. برای درک بهتر مثالی را مورد بررسی قرار میدهیم.
استخلاف اتیل از استخلاف متیل اولویت بالاتری دارد. همانطور که در تصویر زیر مشاهده میکنید هر دوی آنها در اتصال به مرکز کایرال دارای یک اتم کربن هستند، بنابراین از این اتم نمیتوان اولویت آنها را مشخص کرد.
با پیشروی در زنجیره متوجه میشویم که به استخلاف متیل تنها ۳ اتم کربن دیگر متصل است در حالی که استخلاف اتیل به ۲ اتم هیدروژن و ۱ اتم کربن دیگر اتصال دارد، بنابراین از آنجا که این کربن اولین نقطه تفاوت آنها است و از هیدروژن عدد اتمی بالاتری دارد، اولویت با استخلاف اتیل است.
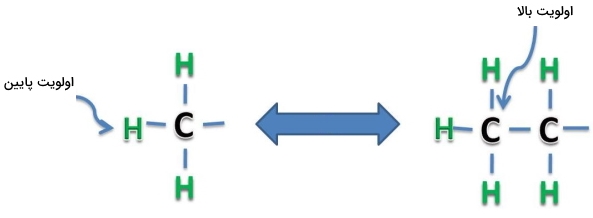
قانون سوم
در صورتی که زنجیرهای چندین بار به اتم یکسانی متصل باشد، باید به دنبال اتمهای بعدی باشیم که بالاترین عدد اتمی را داشته باشند. اگر هیچ کدام از اتمها اولویت نداشته باشند، اولویت با زنجیرهای است که به دفعات بیشتری متصل شده باشد. برای مثال به تصویر زیر توجه کنید که در آن تمامی اتمها یکسان هستند.
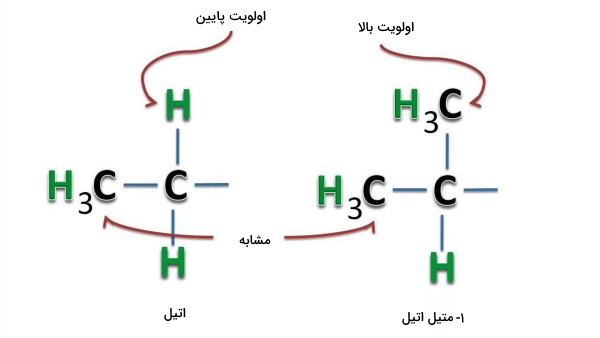
اولویت استخلاف ۱-متیل اتیل از استخلاف اتیل بالاتر است زیرا به اولین کربن آن ۲ کربن دیگر متصل است در حالی که کربن اتیل روی خود تنها ۱ کربن دیگر دارد. همانطور که توضیح دادیم این نقطه اولین تفاوت بین این دو است و از آنجا که عدد اتمی کربن از هیدروژن بیشتر است، اولویت با استخلاف ۱-متیل اتیل خواهد بود. حال به تصویر زیر توجه کنید.
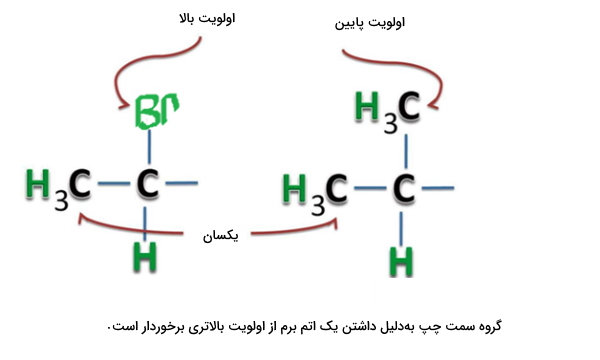
در تصویر بالا به هر کدام از اتمهای کربن یک هیدروژن و یک گروه متیلی متصل است و تفاوت در یکی از پیوندها مشاهده میشود. در مولکول سمت راست این اتصال متیل و در مولکول سمت چپ برم است. از آنجا که عدد اتمی برم از کربن بالاتر است، اولویت با آن خواهد بود.
در صورتی که دو اتم با یکدیگر پیوند دوگانه و سهگانه داشته باشند، به این معناست که ۲ یا ۳ بار به استخلافهای مشابهی متصل شدهاند. برای مثال در تصویر زیر معادل پیوندهای دوگانه کربن کربن را مشاهده میکنید.
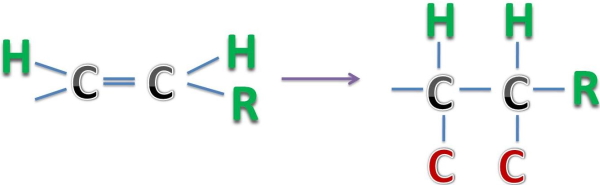
همچنین معادل پیوند سهگانه کربن کربن را در زیر مشاهده میکنید.
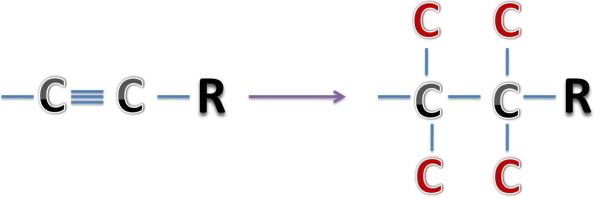
در تصویر زیر مثال دیگری را مشاهده میکنید که اهمیت یافتن اولین مکان تفاوت را مشخص میکند. با یافتن اولین نقطه تفاوت، اتمهایی که در مرحله بعد به استخلاف متصل هستند، فاقد اهمیت خواهند بود.
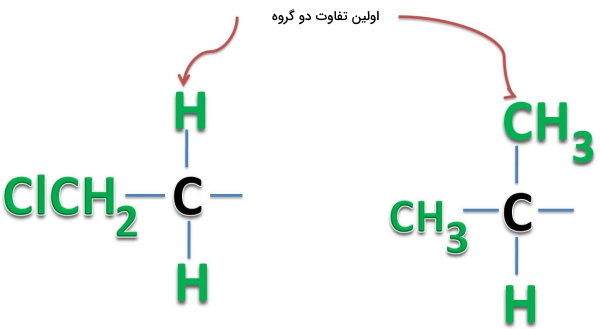
در تصویر زیر به مولکول سمت راست ۱ عدد هیدروژن و ۲ عدد کربن و به مولکول سمت چپ، ۲ عدد هیدروژن و ۱ عدد کربن وصل است، بنابراین میتوان با اطمینان اولویت را به مولکول سمت راست داد. وجود کلر در اتصال به کربن در مولکول سمت راست در اختصاص اولویت آن تفاوتی ایجاد نمیکند.
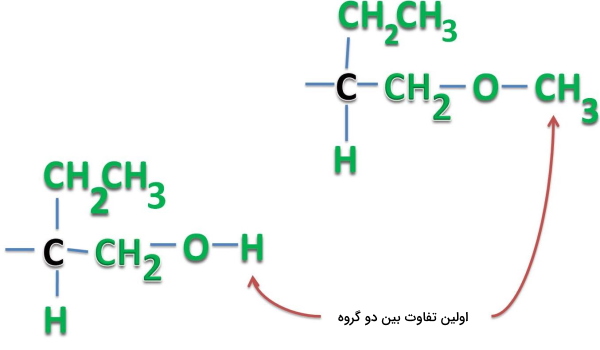
در مواردی با استخلافهایی مواجه میشویم که تا چندین اتصال کاملا با یکدیگر برابر هستند. در چنین مورادی باید تا جایی در زنجیره پیشروی کنیم تا به اولین نقطه تفاوت برسیم. برای مثال در تصویر زیر وجود هیدروژن در مولکول سمت چپ و وجود کربن در مولکول سمت راست اولین نقطه تفاوت است که به مولکول دارای کربن اولویت میدهد.
دیاسترومر چیست؟
«دیاسترومرها» (Diastereomers) گروهی دیگر از ایزومرهای نوری هستند که تصویر آینهای یکدیگر نیستند. در دیاسترومرها آرایش گروهها پیرامون یک یا تعداد بیشتری اتم با یکدیگر متفاوت است در حالی که اتمهایی با آرایش پیرامون یکسان نیز حضور دارند. همانطور که در تصویر زیر مشاهده میکنید، جهتگیری گروهها روی اولین و سومین کربن متفاوت است اما گروههای کربن دوم مشابه یکدیگر هستند و این باعث ایجاد تفاوت در دو مولکول میشود.
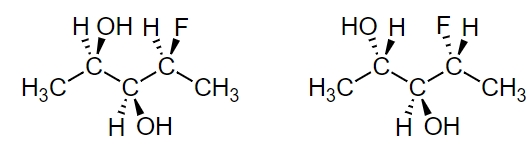
اپیمر چیست؟
«اپیمرها» (Epimers) زیرمجموعه دیاسترومرها هستند که تنها در یک موقعیت با یکدیگر تفاوت دارند. بنابراین میتوان اینطور بیان کرد که تمامی اپیمرها دیاسترومر هستند اما هر دیاسترومری اپیمر نیست. در تصویر زیر نمونه دو مولکول بالا را در موقعیتی مشاهده میکنید که اپیمر هستند.
مثال از تعیین پیکربندی
حال به قوانین مسلط بر تعیین پیکربندی مراکز فضایی آشنا شدیم، میخواهیم در این بخش مثالهای متعددی را مورد بررسی قرار دهیم.
مثال اول
در تصویر زیر ۵ مولکول متفاوت را مشاهده میکنید. ابتدا حضور یا عدم حضور مرکز فضایی را در آنها مشخص کنید و سپس در صورت وجود پیکربندی مطلق آن را با توجه به مجموعه قوانین گفته شده به دست آورید.
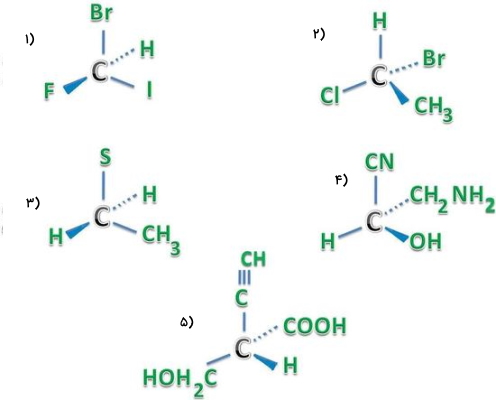
مولکول ۱
کربن این مولکول مرکز کایرال است زیرا به آن ۴ اتم مختلف وصل شده است. با توجه به عدد اتمی اولویت آنها را میتوان بهصورت زیر نوشت.
ید > برم > فلوئور > هیدروژن
پیش از رسم فلش چک میکنیم که هیدروژن که استخلاف با کمترین اولویت است در پشت صفحه باشد که چنین است و با نقطهچین رسم شده است. در صورتی که از ید به برم و سپس فلوئور فلشی رسم کنیم جهت حرکت آن پادساعتگرد است و پیکربندی آن از نوع $$S$$ خواهد بود.
مولکول ۲
در این مولکول نیز مرکز فضایی وجود دارد و اولویت استخلافهای متصل بهصورت زیر خواهد بود.
برم > کلر > متیل > هیدروژن
همانطور که مشاهده میکنید برم با بالاترین اولویت در پشت صفحه قرار دارد و با نقطهچین نشان داده شده است، بنابراین پیش از رسم فلش باید مولکول را بچرخانیم. در این صورت با رسم فلش از برم به کلر و سپس متیل، جهت آن ساعتگرد است و پیکربندی از نوع $$R$$ خواهد بود.
مولکول ۳
در این مولکول دو اتم هیدروژن روی کربن مرکزی قرار دارد، بنابراین فاقد مرکز فضایی است و نمیتوان پیکربندی $$R$$ و $$S$$ را به آن نسبت داد.
مولکول ۴
به کربن مرکزی این مولکول، ۴ استخلاف متفاوت متصل است که اولویت آنها را میتوان بهصورت زیر نوشت.
$$OH > CN > CH_2NH_2 > H $$
همانطور که مشاهده میکنید هیدروژن در پشت مولکول نیست و باید آن را چرخاند. بعد از این کار اگر از استخلاف ۱ به ۲ و سپس ۲ فلشی رسم کنیم، پیکربندی از نوع $$R$$ خواهد بود زیرا جهت فلش ساعتگرد است.
مولکول ۵
ابتدا اولویت استخلافهای این مولکول را تعیین میکنیم که با توجه به قوانین گفته شده بهصورت زیر است.
$$ COOH > CH_2OH >Cequiv CH > H$$
پیکربندی این مولکول از نوع $$S$$ است زیرا جهت حرکت فلش رسم شده پادساعتگرد خواهد بود.
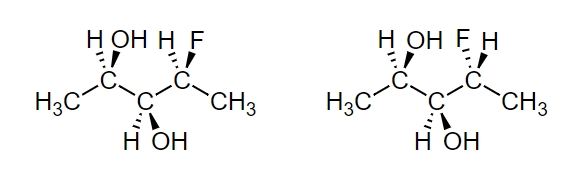
مثال دوم
پیکربندی مطلق مراکز فضایی دو مولکول زیر را پیدا کنید و بگویید چه رابطهای با یکدیگر دارند؟
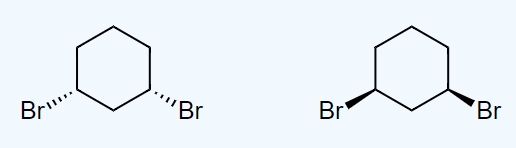
پاسخ
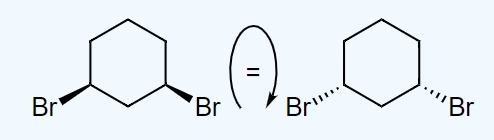
هر دو این ساختارها دارای فرمول شیمیایی و نحوه اتصال یکسان هستند. به تصویر زیر که در آن مولکول سمت راست چرخانده شده است، توجه کنید. نتیجهای که به دست میدهد همان مولکول سمت چپ است، بنابراین میتوان گفت که این دو ساختار مشابه هم و با شیمی فضایی $$R$$ و $$S$$ هستند.
انواع ایزومر در کمپلکسها
تا اینجا با انواع ایزومری در ترکیبات شیمیایی آشنا شدیم. در این بخش میخواهیم بهطور ویژه به انواع ایزومری در کمپلکسها بپردازیم.
ایزومر یونش
«ایزومر یونش» (Ionization Isomerism) زمانی اتفاق میافتد که لیگاند متصل به مرکز فلزی جای خود را با آنیون یا مولکولی خنثی که خارج از شبکه کمپلکس قرار دارد، عوض میکند. برای مثال یک ایزومر هشتوجهی دارای ۵ لیگاند مشابه است اما ششمین لیگاند با آنها متفاوت خواهد بود. این لیگاند غیرمشابه همان مولکول یا آنیون بیرون از فضای شبکه در ایزومر دیگر است.
از آنجا که در این دو ایزومر، آنیون یا مولکول بیرون از شبکه متفاوت خواهند بود، شاهد تغییر در ویژگیهای مولکول نیز هستیم. ایزومر هیدراتی نوعی از ایزومر یونش است که در آن مولکول آب یکی از مولکولهای تبادلی است. برای مثال به دو ایزومر یونش موجود در تصویر زیر توجه کنید.
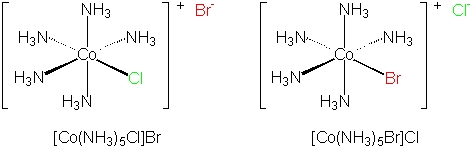
تفاوت این دو ایزومر در لیگاند متفاوت متصل به مرکز فلزی و مولکول موجود در خارج از شبکه است. در مولکول سمت چپ، یون کلر به کبالت به صورت یک لیگاند متصل است و برم در خارج از شبکه کمپلکس، نقش «یون مخالف» (Counter Ion) را ایفا میکند.
مولکول سمت راست دقیقا برعکس این است، یعنی در آن برم، لیگاند متصل به فلز مرکزی و کلر یون مخالف است. توجه داشته باشید که این تفاوت را در نحوه نامگذاری آن ها نیز یادآور میشویم. نام مولکول سمت چپ «پنتا آمین کلرو کبالت (II) برمید» و نام مولکول سمت راست «پنتا آمین برمو کبالت (II) کلرید است.
تفاوت این دو ایزومر در یون تولید شده توسط آنها در زمان انحلال نیز مشاهده کرد. برای مثال زمانی که مولکول پنتا آمین برمو کبالت (II) کلرید در آب حل میشوند، یون $$Cl^-$$ به وجود میآید که میتوانید واکنش آن را در زیر مشاهده کنید.
$$ {CoBr(NH_3)_5Cl {(s)} rightarrow CoBr(NH_3)^{+}_5 (aq) + Cl^{-} (aq)} $$
در حالی که با انحلال مولکول پنتا آمین کلرو کبالت (II) برمید، یون حاصل برم خواهد بود. واکنش این انحلال را در زیر مشاهده میکنید.
$$ {CoCl(NH_3)_5Br {(s)} rightarrow CoCl(NH_3)^{+}_{5} (aq) + Br^{-} (aq)} $$
ایزومر کوئوردیناسیون
«ایزومر کوئودریناسیون» (Coordination Isomer) در ترکیباتی مشاهده میشود که دارای دو بخش کاتیونی کمپلکسی و آنیونی کمپلکسی هستند که در آنها تبادل لیگاندها از کاتیون به آنیون ممکن باشد. در این صورت دو ترکیب کمپلکسی به یکدیگر متصل هستند که یکی از آنها دارای بار مثبت و دیگری دارای بار منفی است. نمونهای از این نوع ایزومری را میتوانید در تصویر زیر مشاهده کنید.

در این مثال از مجله فرادرس، همانطور که مشاهده میکنید جایگاه مس و روی در دو لیگاند دستخوش تغییر میشود.
ایزومر اتصالی
«ایزومر اتصالی» (Linkage Isomer) در لیگاندهای دودندانه مشاهده میشود که بیش از یک روش برای ایجاد شبکه از خود نشان میدهند. از شناختهشدهترین آنها میتوان به زوج $$SCN^- و $$NCS^-$$ و زوج $$NO_2^-$$ و $$ONO^-$$ اشاره کرد. در واقع تفاوت ایزومرهای اتصالی در اتمی از لیگاند است که به یون مرکزی وصل میشود.
لیگاندها باید دارای بیش از یک اتم دهنده باشند اما تنها از یک موضع خود به یون متصل میشوند. برای مثال $$NO_2^-$$ لیگاندی است که میتواند از اتم اکسیژن یا نیتروژن خود به اتم مرکزی وصل شود اما در عین حال توانایی اتصال به آن را بهصورت همزمان توسط نیتروژن و اکسیژن ندارد. برای درک بهتر این نکته به تصویر زیر توجه کنید.
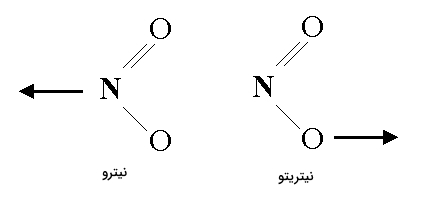
مولکول سمت راست نیتریتو نامیده میشود و از اتم اکسیژن به یون مرکزی متصل خواهد شد، در حالی که مولکول چپ با نام نیترو از نیتروژن خود وصل میشود. از آنجا که ایزومرهای ساختاری فرمول مشابه یکدیگر دارند، فرمول کمپلکس آنها تغییری نخواهد کرد اما ویژگیهایی که از خود بروز میدهند ممکن است متفاوت از یکدیگر باشد.
از دیگر لیگاندهایی که به تولید ایزومر اتصال میانجامند، میتوان به سلنوسیانات با فرمول شیمیایی $$SeCN^-$$، ایزوسلنوسیانات با فرمول شیمیایی $$NCSe^-$$ و سولفیت با فرمول شیمیایی $$SO_3^{2-}$$ اشاره کرد.
ایزومر هندسی مسطح
کمپلکسهای فلزی که تنها در نوع مجاورت لیگاندها نسبت به یکدیگر با هم متفاوت هستند، ایزومر هندسی نامیده میشوند. در صورتی لیگاندهای مشابه در کنار یکدیگر باشند، ایزومر هندسی از نوع سیس و در صورتی که روبروی یکدیگر قرار بگیرند، ایزومر هندسی از نوع ترانس خواهد بود. این نوع ایزومری در کمپلکسهای مسطح و هشتوجهی از اهمیت بهسزایی برخوردار است که در ادامه به آنها خواهیم پرداخت.
ابتدا کمپلکس $$MA_3B$$ را بررسی میکنیم. از آنجا که راسهای مربع با یکدیگر برابر هستند، محل قرارگیری لیگاند $$B$$ در آن اهمیت ندارد و تفاوتی ایجاد نمیکند. بنابراین میتوان با اطمینان گفت که این کمپلکس تنها یک ایزومر هندسی دارد که آنها را در تصویر زیر مشاهده میکنید.
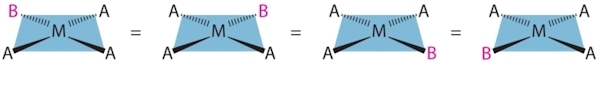
همانطور که مشاهده میکنید هر ۴ ساختار از نظر شیمیایی با یکدیگر برابر هستند و تنها با چرخش کمپلکسها میتوان آنها را بر هم منطبق کرد. برای کمپلکسی بهصورت $$MA_2B_2$$ دو ایزومر امکان مطالب درسی...
برچسب : نویسنده : خنجی darsi بازدید : 112
آرشیو مطالب
- مرداد 1392
- دی 1394
- بهمن 1394
- فروردين 1395
- ارديبهشت 1395
- خرداد 1395
- تير 1395
- بهمن 1396
- اسفند 1396
- شهريور 1396
- دی 1397
- بهمن 1397
- ارديبهشت 1397
- تير 1397
- آبان 1397
- آذر 1397
- دی 1398
- بهمن 1398
- اسفند 1398
- ارديبهشت 1398
- مرداد 1398
- مهر 1398
- آذر 1398
- دی 1399
- بهمن 1399
- اسفند 1399
- فروردين 1399
- خرداد 1399
- تير 1399
- مرداد 1399
- شهريور 1399
- مهر 1399
- بهمن 1400
- اسفند 1400
- فروردين 1400
- ارديبهشت 1400
- خرداد 1400
- تير 1400
- مرداد 1400
- دی 1401
- بهمن 1401
- اسفند 1401
- فروردين 1401
- ارديبهشت 1401
- خرداد 1401
- تير 1401
- مرداد 1401
- شهريور 1401
- مهر 1401
- آبان 1401
- آذر 1401
- دی 1402
- بهمن 1402
- اسفند 1402
- فروردين 1402
- ارديبهشت 1402
- خرداد 1402
- تير 1402
- مرداد 1402
- شهريور 1402
- مهر 1402
- آبان 1402
- آذر 1402
- فروردين 1403
- ارديبهشت 1403


