در آموزشهای قبل «مجله فرادرس» با جدول تناوبی عناصر و روشهای حفظ کردن جدول آشنا شدیم. همچنین، گروههای مختلف جدول تناوبی را یاد گرفتیم. دو دسته که جزو گروه فلزات واسطه بودند را با نامهای لانتانیدها و اکتیندها شناختیم. در این آموزش قصد داریم تا توضیحات تکمیلی در خصوص لانتانیدها و اکتینیدها ارائه کنیم.
مقدمه
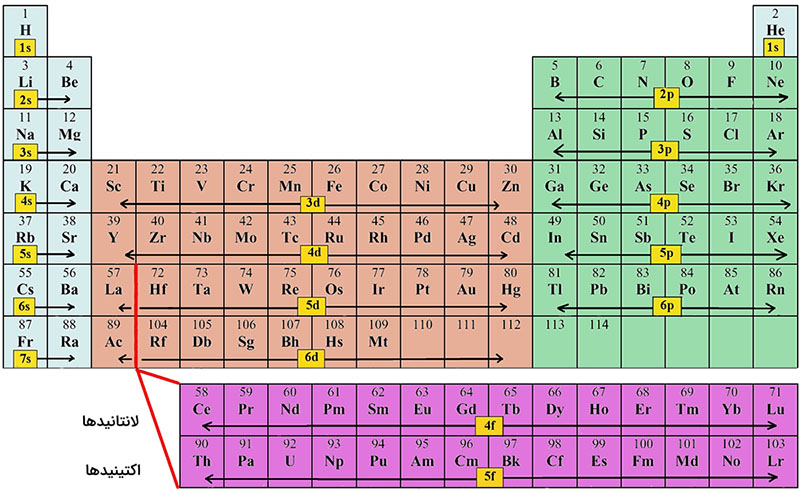
اگر به جدول تناوبی در تصویر زیر نگاه کنیم، دو ردیف صورتیرنگ را در بیرون جدول پیدا خواهیم کرد که یکی، بین عناصر باریم و هافنیوم و دیگری در میان عناصر رادیم و رادرفوردیم قرار دارد. این دو کادر، شامل عناصری با زیرلایه پرنشده f هستند. در حقیقت، برای اینکه نظم و ترتیب در جدول تناوبی عناصر حفظ شود، عناصر این دو کادر را به پایین جدول منتقل کردهاند.
هرقدر تعداد الکترون در یک اتم افزایش مییابد، رفتارهای متفاوتی را شاهد خواهیم بود. میدانیم که برخی از سطوح انرژی (لایهها) در عناصر، بعد از پر شدن لایه خارجی، شروع به پر شدن میکنند. این پدیده، در دو گروه از عناصر به نامهای لانتانیدها و اکتینیدها قابل تشخیص است.
بلوک f در لانتانیدها و اکتینیدها
اولین زیرلایهای که در بلوک f پر میشود، زیرلایه $$4f$$ است که بعد از زیرلایه $$6s$$ پر میشود. هفت اوربیتال بلوک f میتوانند تا ۱۴ الکترون را در خود جای دهند و این بدان معنی است که این بلوک میتواند شامل ۱۴ عنصر باشد. به همراه دو عنصر لانتانیوم و اکتینیوم که در بلوک d قرار دارند، لانتانیدها و اکتیندها هرکدام شامل ۱۵ عنصر هستند.
تعداد عناصر در لانتانیدها و اکتینیدها
برخی از متون شیمی، به اشتباه دو عنصر ابتدایی در لانتانیدها و اکتینیدها را نیز جزو بلوک f محسوب میکنند که امری اشتباه است. همچنین، در برخی منابع، به اشتباه، تعداد عناصر در لانتانیدها و اکتینیدها را ۱۴ عنصر ذکر کردهاند بلکه باید به این نکته اشاره کرد که عناصر بلوکهای $$4f$$ و $$5f$$ هرکدام شامل ۱۴ عنصر هستند و با احتساب دو عنصر لانتانیوم و اکتینیوم، تعداد عناصر در لانتانیدها و اکتیندها به ۱۵ میرسد.
اگر بخواهیم به طور دقیقتر این مساله را توضیح دهیم باید بگوییم که به طور مثال، واژه لانتانید به معنای «شبیه لانتانیوم» است و نمیتوان عنصر لانتانیوم را یک لانتانید دانست و در برخی منابع، این عنصر را در گروه ۳ جدول تناوبی قرار میدهند اما آیوپاک، این عنصر را نیز به دلیل استفاده رایج آن، در دسته لانتانیدها قرار داده است.
خواص عنصری در لانتانیدها و اکتینیدها
لانتانیدها به لحاظ شیمیایی با عناصر در گروههای اصلی جدول تناوبی و همچنین فلزات واسطه تفاوت دارند. این تفاوت به دلیل طبیعت زیرلایه f در آنها است. این اوربیتالها در داخل اتم قرار گرفتهاند و توسط الکترونها در اوربیتالهای $$4d$$ و $$5p$$ پوشیده شدهاند. به همین دلیل، خواص شیمیایی این عناصر به اندازه آنها وابسته است که این مقدار، با افزایش عدد اتمی، افزایش پیدا میکند.
اکتینیدها همانند سایر فلزات و نرم هستند. تمامی آنها رنگی نقرهای دارند که در برابر هوا، کِدر میشوند. علاوه بر این، اکتینیدها دارای چگالی و پلاستیسیته بالایی هستند. برخی از اکتینیدها همچون فلزات قلیایی با چاقو برش میخورند. عنصری مثل «توریم» (Thorium) را میتوان حرارت داد و همانند فولاد، آن را به ورقههایی تبدیل کرد. چگالی این عنصر در حدود نصف چگالی اورانیوم و پلوتونیوم و از هردو این عناصر سنگینتر است.
برخلاف لانتانیدها، بیشتر اکتینیدها، خواص مشابه بلوک d را دارند. این عناصر، با از دست دادن چندین الکترون، اعداد اکسایش متفاوتی بدست میدهند که نتیجه آن بوجود آمدن یونهای مختلف است. تمامی اکتینیدها رادیواکتیو و پارامغناطیس هستند و به غیر از اکتینیوم، بقیه دارای «فاز بلورین» (Crystalline Phase) هستند. علاوه بر این، تمامی اکتینیدها زمانی که در معرض هوا قرار بگیرند، به طور خود به خودی واکنش میدهند و ایجاد شعله میکنند.
نقطه ذوب اکتینیدها، وابستگی مشخصی به تعداد الکترونهای اوربیتالهای f ندارد. نقطه ذوب غیر معمول و پایین نپتونیم و پلوتونیوم – در حدود 640 درجه سانتیگراد – را به دلیل هیبرید شدن اوربیتالهای $$5f$$ و $$6d$$ و تشکیل پیوندهای جهتدار در این فلزات ذکر میکنند.
همچون لانتانیدها، تمامی اکتینیدها به شدت با هالوژنها و کالکوژنها واکنش میدهند. البته در این میان، اکتینیدها سادهتر وارد واکنش میشوند. اکتینیدها، خاصه آنهایی که تعداد کمی الکترون در اوربیتال $$5f$$ دارند، مستعد هیبرید شدن هستند. این مورد را با شباهت انرژی الکترونها در زیرلایههای $$5f$$، $$7S$$ و $$6d$$ توصیف میکنند.
اعداد اکسایش در لانتانیدها و اکتینیدها
لانتانیدها را با اعداد اکسایش $$+3$$ میشناسند و در گذشته تصور میشد که تنها عناصر «ساماریم» (Samarium)، «یوروپیم» (Europium) و «ایتریبیم» (Ytterbium) به عدد اکسایش $$+2$$ در محلولها میرسند اما امروزه دانشمندان به این نتیجه رسیدهاند که تمامی لانتانیدها، کمپلکسهایی به صورت $$+2$$ تشکیل میدهند. در مقابل، اکتینیدها، اعداد اکسایش متفاوتی از $$+2$$ تا حتی $$+6$$ دارند.
کاربرد لانتانیدها
از لانتانیدها به طور گسترده در آلیاژها برای افزایش سختی و استحکام فلزات استفاده میشود. عنصر اصلی که برای این منظور از آن بهره میگیرند، «سریم» (Cerium) است که با مقادیری از سایر عناصر این گروه ترکیب میشود. همچنین از این فلزات به طور گسترده در صنایع نفتی برای پالایش نفت خام کمک میگیرند.
همچنین، از عنصر «اربیم» (Erbium) و سایر لانتانیدها در دستگاههای نوری همچون دوربینهای دید در شب، پرتوهای لیزر و مواد فسفرسانس بهره میگیرند.
انرژی یونش در لانتانیدها
انرژی یونش در لانتانیدها را میتوان با آلومینیوم مقایسه کرد. در آلومینیوم، مجموع سه انرژی یونش اول برابر با $$5139 kJ . mol ^ {-1}$$ است در حالیکه برای لانتانیدها این مقدار در بازه $$3455 – 4186 kJ . mol ^ {-1}$$ قرار میگیرد. دلیل این امر، واکنشپذیری بالای لانتانیدها ذکر میشود.
کاربرد اکتینیدها
از آنجایی که اکتینیدها همگی موادی رادیواکتیو هستند، در همین زمینه نیز به کار گرفته میشوند. از این عناصر به عنوان منبع انرژی در مسائل مختلفی همچون «ضربانسازها» (Pacemaker) در قلب و تولید انرژی الکتریکی در دستگاههای فضایی کمک میگیرند. از اورانیوم و پلوتونیوم نیز در نیروگاهها و بمبهای هستهای استفاده میکنند. همچنین، اکتینیدها در ساخت آشکارسازهای دود و «توریهای روشنایی» (Gas Mantles) کاربرد دارند.

اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- اوربیتال مولکولی — به زبان ساده
- الکترونگاتیوی — از صفر تا صد
^^